5. Fuentes del colesterol endógeno – Efecto de dietas ricas en hidratos de carbono
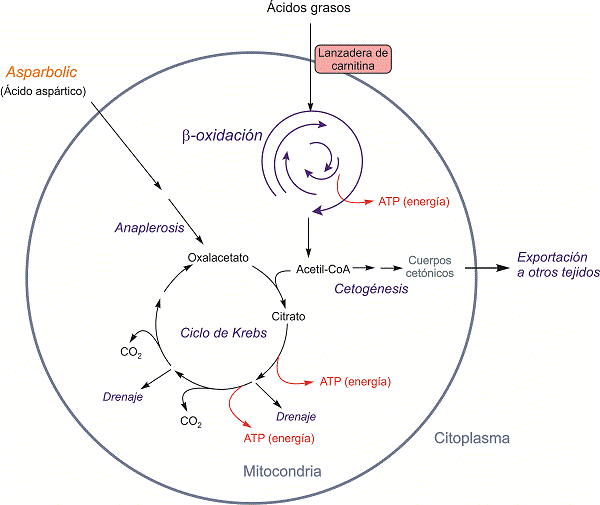
La síntesis de colesterol, igual que la de ácidos grasos, ocurre en el citoplasma celular, a partir del intermediario metabólico acetil-CoA. El acetil-CoA procede principalmente de la degradación de hidratos de carbono y de ácidos grasos, y se produce en las mitocondrias donde se consume como principal intermediario energético. Pero este intermediario no se puede consumir independientemente sino que para ello se tiene que combinar con otro: oxalacetato. El oxalacetato se regenera en la ruta de consumo de acetil-CoA originando una ruta cíclica: el ciclo de Krebs, que es la ruta central del metabolismo energético. Sin embargo, no todo el oxalacetato que entra en el ciclo se recupera porque algunos productos intermedios de esta ruta se usan para otros propósitos (síntesis de aminoácidos, hemoglobina, citocromos y otros). Este drenaje perjudica la regeneración del oxalacetato mermando la capacidad del ciclo.
Figura 7. Cetogénesis: síntesis de cuerpos cetónicos cuando el ciclo de Krebs no puede dar cuenta de todo el acetil-CoA producido en la oxidación de ácidos grasos, por haber escasez de oxalacético debido a la falta de precursores anapleróticos. El ácido aspártico principio activo de nuestro producto Asparbolic resuelve este problema como fuente anaplerótica.
Este drenaje se compensa con varias rutas metabólicas que producen oxalacetato directamente; este proceso de recuperación se denomina anaplerosis o cebadura (del griego rellenar o cebar). Para que el ciclo de Krebs funcione correctamente tienen que estar funcionando muy bien las rutas anapleróticas a fin de compensar su drenaje. Cuando éstas no funcionan bien, normalmente por escasez de precursores metabólicos de oxalacetato, la producción de acetil-CoA es superior a la capacidad para consumirlo, y el metabolismo acude a sistemas de aliviadero de acetil-CoA para evitar que se acumule este intermediario, convirtiéndolo en otros productos que se exportan a otros tejidos que puedan consumirlos.
Síntesis de cuerpos cetónicos: Cetogénesis. Si procede de la degradación de ácidos grasos, el exceso de acetil-CoA se convierte en las mitocondrias en cuerpos cetónicos (acetoacetato, b–hidroxibutirato y acetona). El hígado es el principal productor de cuerpos cetónicos y si este problema es agudo puede ocasionar cetosis (figura 7).
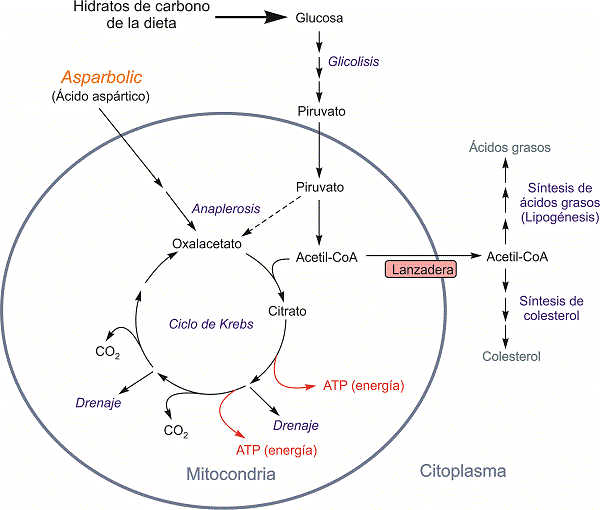
Síntesis de colesterol. Si procede de la degradación de hidratos de carbono, el exceso de acetil-CoA se saca de la mitocondria al citoplasma donde se convierte en ácidos grasos y en colesterol (figura 8). En el citoplasma, la síntesis de colesterol actúa como aliviadero de acetil-CoA, y así, un motivo de la síntesis intensiva de colesterol es un exceso de hidratos de carbono en la dieta. Este efecto explica que en muchos casos la obesidad producida por exceso de síntesis de ácidos grasos vaya acompañada del exceso de colesterol. Además, la síntesis de colesterol como aliviadero del acetil-CoA citoplásmico se comprueba en los diabéticos, donde al haber una disminución de la síntesis de ácidos grasos debida al deficiente efecto de la insulina, aumenta la síntesis de colesterol al desviar el uso del acetil-CoA por esa ruta [1].
El hígado debe fabricar colesterol en su justa medida, y para esta función el citoplasma demandará el acetil-CoA que necesite, pero hay que evitar su síntesis masiva, para lo cual no hay que forzar su salida de las mitocondrias al citoplasma, lo cual se produce inevitablemente cuando hay exceso de hidratos de carbono en la dieta. Por tanto, una causa importante del exceso de colesterol es la abundancia de hidratos de carbono de la dieta, y una forma de evitarlo es reducirlos.
Figura 8. Síntesis de ácidos grasos y colesterol cuando el ciclo de Krebs no puede absorber todo el acetil-CoA procedente de la degradación de hidratos de carbono.
Fuentes de rutas anapleróticas – Asparbolic
Durante mucho tiempo se ha creído que la glucosa, como fuente de oxalacetato a través de piruvato, era el principal material anaplerótico (véase la figura 8), y que por tanto los hidratos de carbono podrían favorecer el uso de ácidos grasos como combustibles. Esta suposición, sin embargo, no estaba bien soportada por estudios nutricionales, que relacionaban una dieta baja en hidratos de carbono con disminución de obesidad y de colesterol [2]. Finalmente, la cuestión quedó resuelta en los años 1990, con estudios bioquímicos que demostraron que el exceso de hidratos de carbono no sólo no favorece la degradación de ácidos grasos sino que produce el efecto contrario. El bajo consumo metabólico de grasa no se debe al contenido calórico de la dieta, sino que la glucosa no es un buen precursor anaplerótico por dos motivos:
1. La insulina, cuya secreción se estimula con una dieta rica en carbohidratos, reduce fuertemente la actividad de la piruvato carboxilasa, enzima anaplerótica a partir de piruvato en el hígado, al bloquear la expresión del gen que codifica su síntesis [3]. Además, la insulina y la glucosa también promueven la lipogénesis (síntesis de ácidos grasos), que es la causa primaria de la obesidad y del síndrome metabólico.
2. la enzima piruvato carboxilasa, que se había supuesto su principal ruta anaplerótica (a partir de la glucosa) tiene poca actividad en el corazón y muy poca o ninguna en el músculo (principales consumidores de ácidos grasos como combustibles energéticos, por lo que no puede atender esta necesidad [4].
Por el contrario, varios estudios en los años 1960-1970 [5,6] habían sugerido que el ácido aspártico (uno de los veinte aminoácidos constituyentes de las proteínas, y, a su vez, un importante intermediario metabólico para la síntesis de otros productos) podría ser un importante precursor anaplerótico en músculo y corazón. Sin embargo, desde entonces no se había insistido en demostrar este efecto. Como tantas otras veces, aquellos resultados parecían haberse quedado en el olvido, pues la investigación sobre la obesidad, el exceso de colesterol y, en general, el síndrome metabólico, buscaban otras causas.
En nuestra investigación sobre el metabolismo, primero en la Universidad de La Laguna y luego en el Instituto del Metabolismo Celular, hemos estudiado origen evolutivo del ciclo de Krebs y su funcionamiento [7] y posteriormente, hemos demostrado el papel preponderante del ácido aspártico como principal precursor anaplerótico [8-10].
Basándonos en estos resultados de nuestra investigación hemos diseñado en el Instituto del Metabolismo Celular el complemento nutricional Asparbolic basado en ácido aspártico. Su uso en las dosis adecuadas, combinado con el sistema de alimentación que recomendamos, ha demostrado tener una gran eficacia para combatir y evitar el exceso de colesterol. En esta sección está explicado el fundamento científico de este producto y de las recomendaciones dietéticas. Puede verse más información en las secciones Asparbolic, Síndrome metabólico, Obesidad y Diabetes.
Referencias
?Capítulo anterior: 4 – Síntesis endógena de colesterol
Capítulo siguiente: 6 – Colesterol y dieta
Enlaces relacionados de esta página Web:
Metabolismo
Hidratos de carbono
Ácidos grasos
Lipogénesis
Obesidad
Cetosis
Síndrome metabólico
Alimentación y dieta
Problemas de salud que podemos atender
Nuestros complementos nutricionales NutrHevia
Asparbolic