4. Síntesis metabólica de colesterol
La mayor parte del colesterol que tenemos en el cuerpo no procede de la dieta sino de su síntesis endógena. El metabolismo humano, como el de todos los animales sintetiza colesterol. Una persona normal (no obesa ni diabética) sintetiza diariamente entre 9 y 13 mg por kg de masa corporal. Así una persona de 70 kg sintetiza entre 630 y 900 mg de colesterol diariamente. Esta síntesis se hace en varios órganos y tejidos, pero el principal es el hígado que da cuenta del 50-75%% de la producción. Le sigue la corteza adrenal y las glándulas sexuales (10-22%), el intestino (7-18%), las células plasmáticas (5%), y los pulmones (3%); otros órganos y tejidos como la piel, riñones, cerebro, músculo y adiposo, tienen una participación mínima (entre 0,2 y 1%).
La ruta de síntesis de colesterol es una de las más largas y complejas del metabolismo. El proceso, igual en todos los tejidos y en todos los animales, tiene veinte pasos, con la participación de muchas enzimas y proteínas diferentes (figura 6), y multitud de procesos reguladores y transporte de productos por el citoplasma, por las membranas internas de la célula y por los compartimentos intracelulares (retículo endoplásmico y aparto de Golgi).
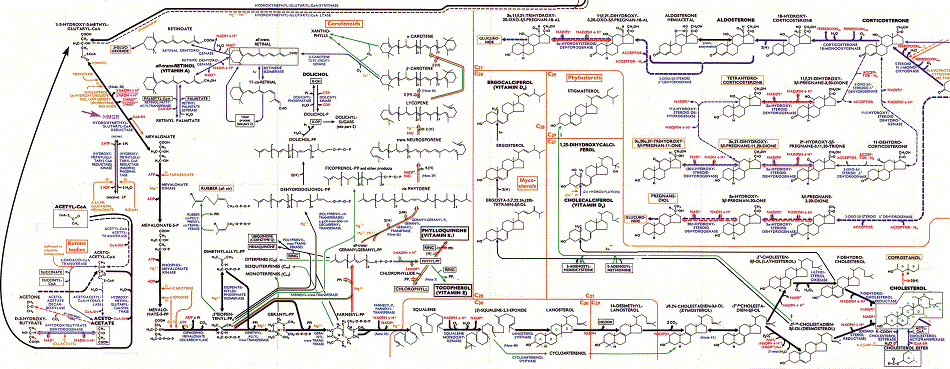 Figura 5. Parte del mapa metabólico con la ruta de la síntesis de colesterol y otros derivados desde acetil-CoA. El proceso completo tiene más de veinte pasos y está regulado en varios puntos, principalmente en la enzima HMG reductasa (HMGR), la primera de su ruta específica (indicada con una flecha violeta, arriba a la izquierda.
Figura 5. Parte del mapa metabólico con la ruta de la síntesis de colesterol y otros derivados desde acetil-CoA. El proceso completo tiene más de veinte pasos y está regulado en varios puntos, principalmente en la enzima HMG reductasa (HMGR), la primera de su ruta específica (indicada con una flecha violeta, arriba a la izquierda.
Regulación de la síntesis de colesterol
Este es el punto más importante que debemos considerar aquí, ya que la mayor parte del colesterol que tenemos en el cuerpo—y la causa de su exceso—no procede del colesterol de la dieta sino de su síntesis endógena. Por tanto, la mejor forma de evitar el exceso de colesterol es comprender bien los mecanismos reguladores que operan sobre su síntesis, especialmente en el hígado, para actuar sobre ellos.
Regulación de la actividad de la enzima HMG reductasa
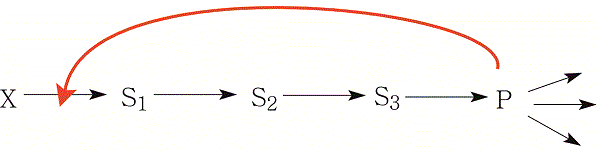
La síntesis metabólica de la mayor parte de los productos se regula mediante un mecanismo cibernético de control negativo o retroalimentación (feed-back), similar al que produce el flotador de un depósito de agua, que al alcanzar un cierto nivel cierra el conducto de alimentación. En muchas rutas metabólicas el producto final inhibe la actividad de la enzima que cataliza el primer paso, como muestra la figura 6.
Este mecanismo general de regulación también funciona, en cierto sentido, en la síntesis de colesterol. Sin embargo, aquí es mucho más complejo, y en parte muy diferente, debido a que la ruta de síntesis de colesterol ocurre en la fracción soluble de la célula, y el colesterol, producto final, es muy insoluble. Estas características complican mucho su regulación y su transporte. El punto principal de regulación es la enzima HMG CoA reductasa (HMGR), primera enzima de la cadena de síntesis. Esta enzima se regula mediante mecanismos que operan sobre su actividad y sobre su cantidad.
Figura 6. Mecanismo de inhibición feed-back (retroalimentación). El producto P que se va a usar para diversas funciones se produce mediante una cadena de reacciones a partir del precursor X a través de una cadena de intermediarios S1, S2,… Este producto interacciona con la primera enzima de la cadena (o con una de las primeras) inhibiendo su actividad. De esta forma se evita que se produzca P en exceso, y se permite el uso del precursor X para otras funciones. En la síntesis de colesterol este mecanismo también funciona, pero es mucho más complejo, pues en él interviene en mayor medida el colesterol procedente de la dieta.
La enzima HMGR está integrada en la membrana intracelular del retículo endoplásmico, con la parte catalítica en contacto con la fracción citoplásmica soluble, donde ocurre la reacción, y una parte embebida en la membrana, donde interacciona con las proteínas reguladoras y con las lipoproteínas. La mayor parte del colesterol sintetizado es recogido in situ por las lipoproteínas LDL y VLDL, que también se fabrican en el hígado, y el complejo resultante se transporta al interior del retículo endoplásmico, de donde pasa al aparato de Golgi para ser exportado a la sangre. Otra fracción se une a la proteína reguladora intracelular SREBP (sterol regulatory element-binding protein), y el complejo resultante pasa al interior del retículo donde interacciona con la HMGR inhibiendo su actividad. Además la SREBP también interacciona con el aparato genético regulando la síntesis de la enzima (véase más abajo).
Control de la síntesis por el colesterol de la dieta
Sin embargo, el mecanismo de control negativo endógeno, descrito arriba, para frenar la actividad de la HMGR y en consecuencia, la síntesis de colesterol, basado en la cantidad de colesterol que se ha producido, no es del todo eficaz pues no puede detener por completo el proceso, y necesita un mecanismo adicional. Este segundo mecanismo viene gobernado por el colesterol de la dieta y es mucho más eficaz que el primero, pues él solo llega a controlar el 100% del proceso. En efecto, si se suprime el colesterol de la dieta la síntesis de colesterol continúa descontrolada y se sigue produciendo colesterol hasta niveles altos, mientras que si la dieta tiene suficiente colesterol (0,5% de su composición total) su síntesis de detiene totalmente. Varios experimentos han demostrado que en el hígado de ratas alimentadas durante 8 días con una dieta enteramente carente de colesterol se produjo una síntesis de colesterol mucho más alta que el de las ratas control alimentadas con una dieta baja en colesterol, mientras que con un contenido en la dieta de 0,5% de colesterol durante ocho días, la síntesis se detuvo por completo [1]. Los autores de este trabajo hacen notar que sus resultados refutan el consejo de evitar el colesterol en la dieta (son resultados publicados en 1953, y reiteradamente comprobados con posterioridad). Este mecanismo de control por la dieta obedece a razones obvias de economía, y funciona también en otros procesos, como la síntesis de ácidos grasos, de aminoácidos, y de glucosa.
Los datos obtenidos de primates pueden ser más representativos para aplicarlos a la especie humana. Los experimentos con el “mono ardilla” (Samiri oerstedii) de América central mostraron que un contenido de colesterol en la dieta moderado o relativamente alto (0,5-1%) produjo un descenso de síntesis de colesterol del 78,7%, frente al control con un contenido bajo de colesterol (0,04 mg/g) en la dieta. Esta reducción ocurrió principalmente en la síntesis hepática (96%); en otros tejidos hubo una reducción de 25-30%. Sin embargo, en el ovario, cuya contribución al total es muy pequeña (<2%) subió un 245% (llegando al 2,1% de la producción total). A pesar de que este cambio es poco significativo para la totalidad del colesterol sintetizado, es interesante, pues muestra que el ovario tiene su propio mecanismo regulador, con independencia del total: al disponer de menos colesterol para sintetizar las hormonas sexuales, aumenta su producción propia para atender a su demanda particular [2].
Es importante indicar aquí que los ácidos grasos insaturados y poliinsaturados de la dieta también intervienen en el control de la síntesis de colesterol produciendo un efecto sinérgico con el colesterol de la dieta (véase más abajo).
El mecanismo del papel regulador del colesterol de la dieta se conoce bien: en realidad, el colesterol que interacciona con la HMGR, y la inhibe, no es propiamente el colesterol que se ha sintetizado en esta ruta sino el que está unido a las lipoproteínas o la proteína reguladora SREBP que llegan a interaccionar con ella. Estas lipoproteínas son: las LDL que contienen el colesterol que se ha sintetizado in situ; las HDL que contienen el colesterol procedente de los tejidos, y el que van recogiendo de sus depósitos en las arterias, y los remanentes de quilomicrones (CMR) que contienen el colesterol de la dieta [3-5]. La diferencia entre ellas es que el hígado absorbe los CMR con mayor preferencia que las HDL y LDL, y también el colesterol que transportan los CMR se disocia mejor que el de las otras partículas para interaccionar con la HMGR e inhibirla [6-9]. Por tanto, el inhibidor más potente de la síntesis de colesterol es el que se transporta por los CMR, todo el cual procede de la dieta [10,11]. La conclusión general de estos mecanismos es que el colesterol de la dieta es el principal regulador de la síntesis endógena de colesterol, y la forma más eficaz (tomado con moderación) de evitar su exceso [10]. Este efecto se ha demostrado directamente en el laboratorio con remanentes de quilomicrones (CMR) preparados al efecto [11].
Control positivo de la síntesis de colesterol y regulación de la síntesis de las enzimas
Como ocurre en muchos otros procesos metabólicos, además del control negativo que frena la síntesis de colesterol inhibiendo la actividad de la HMGR, también hay un control sobre la cantidad de la enzima disponible. Este control puede ser negativo (frenando la síntesis de la enzima) o positivo (activándola).
Hay, al menos, dos tipos de mecanismos que operan en este sentido: cuando los niveles de colesterol son bajos la proteína reguladora SREBP, en lugar de interaccionar con la enzima HMGR para frenar su actividad, migra al núcleo e interacciona con el DNA (o ADN) y estimula la actividad de los genes que codifican las enzimas para la biosíntesis de colesterol, incluida la síntesis de las lipoproteínas que lo van a exportar (LDL y VLDL).
Regulación hormonal
También hay un control positivo regulado por la hipófisis: Las ratas a las que se ha extirpado la hipófisis pierden prácticamente toda la capacidad de sintetizar colesterol [12]. Sin embargo, a pesar de su evidente interés, este mecanismo, descubierto hace casi sesenta años, y mediado, sin duda, por hormonas hipofisarias, apenas se ha estudiado con posterioridad, ni para confirmarlo ni para rebatirlo. La insulina también parece intervenir en esta regulación, pero no se ha aclarado su función en este sentido.
La síntesis de las enzimas responsables de la síntesis de ácidos grasos (lipogénesis) y de la síntesis de colesterol está controlada por las proteínas reguladoras SREBP: La SREBP-1c activa la transcripción de los genes lipogénicos, responsables de las enzimas que sintetizan los ácidos grasos (principalmente en el hígado); la SREBP-2 activa los genes de la síntesis de colesterol; y el factor SREBP-1a activa los dos tipos. Los ácidos grasos poliinsaturados de la dieta (w-3) y (w-6), reducen la SREBP-1c y aceleran la degradación de los mRNA correspondientes (las moléculas que llevan el mensaje genético para la síntesis de las enzimas). Este efecto no lo hacen los ácidos grasos saturados ni los insaturados (w-9). Por otra parte, la insulina y los carbohidratos también activan la actividad de estos genes [13], de manera que una dieta rica en carbohidratos (que activa la secreción de insulina) aumenta la síntesis de colesterol. Veremos más detalles de este efecto más abajo.
Efecto sobre el control de la síntesis de colesterol por los ácidos grasos de la dieta
Los ácidos grasos poliinsaturados reducen la síntesis y la absorción de colesterol
Los ácidos grasos insaturados de la dieta contribuyen eficazmente a reducir la síntesis endógena de colesterol, así como la de ácidos grasos (lipogénesis), la síntesis y secreción de las lipoproteínas LDL y VLDL, y también contribuyen a eliminar el colesterol depositado en las placas ateroscleróticas. El ácido oleico (w-9), abundante en el aceite de oliva, ha demostrado ser un potente inhibidor tanto de la síntesis de colesterol como de la lipogénesis al reducir la actividad de la acetil-CoA carboxilasa (primera enzima de la ruta de síntesis de ácidos grasos) en un 80% [14]. Otros ácidos grasos poliinsaturados también han demostrado ser muy efectivos: linoleico (w-6, w-9) y linolénico (w-3, w-6, w-9). Los aceites vegetales y el pescado azul son fuentes muy ricas de estos ácidos grasos.
El aceite de oliva contiene 75% de ácido oleico y 10% de linoleico; el aceite de maíz tiene 25% de oleico y 58% de linoleico; el pescado azul (que durante mucho tiempo se aconsejó evitarlo) es especialmente rico en linolénico. La incorporación a la dieta de estos productos ha demostrado muy buenos resultados para evitar y combatir el exceso de colesterol y la obesidad en modelos experimentales y en poblaciones humanas [15-19]. Al estudiar este efecto con más detalle, se vio que los remanentes de quilomicrones preparados en el laboratorio con ácidos grasos procedentes de pescado azul disminuyeron en un 50% la expresión del gen responsable de la liberación de colesterol en hepatocitos de rata [20,21].
Además de estos efectos beneficiosos de los ácidos grasos monoinsaturados y poliinsaturados de los aceites vegetales y el pescado azul de la dieta reduciendo la síntesis y la liberación de colesterol en el hígado, experimentos realizados con dos especies de monos con distinta susceptibilidad a la aterosclerosis demostraron en ambas especies la gran eficacia del ácido linoleico para evitar la deposición en las arterias del colesterol transportado en LDL (causa primaria de la aterosclerosis), haciendo, por tanto, ‘menos malo’ el colesterol-LDL [22].
La causa inmediata de la obesidad y de otras consecuencias del Síndrome metabólico (véase esa sección en este sitio Web) que incluye además diabetes, hipertensión y aterosclerosis, es una elevada síntesis de ácidos grasos saturados, principalmente en el hígado. Los experimentos donde se suministraron remanentes de quilomicrones cargados con ácidos grasos poliinsaturados w-3 a hepatocitos en cultivo suprimieron también la secreción de triglicéridos en VLDL (además de la reducción de la secreción de colesterol [23,24]. Al estudiar con detalle los mecanismos de estos efectos se ha visto que los ácidos grasos poliinsaturados actúan sinérgicamente con el colesterol interfiriendo en la expresión de los genes que codifican las enzimas de la síntesis de colesterol y de ácidos grasos [23,24].
A la vista de todos estos resultados, la dieta más recomendable para evitar y combatir el exceso de colesterol debe contener en general: poca grasa, pero de ella, pocos ácidos grasos saturados, y una alta proporción de ácidos grasos insaturados y poliinsaturados; además una dieta saludable debe tener una cantidad moderada de colesterol [22,25] y pocos hidratos de carbono, como explicamos en el capítulo 6 (Colesterol y dieta). Pueden verse más detalles en la sección Alimentación y dieta en este sitio Web.
Referencias
1. Tomkins, G. M., Sheppard, H. & Chaikoff, I. L. (1953) Cholesterol synthesis by liver. III. Its regulation by ingested colesterol. Journal of Biological Chemistry, 201, 137-141.
2. Dietschy, J. M. & Wilson, J. D. (1968) Cholesterol synthesis in the Squirrel monkey: relative rates of synthesis in various tissues and mechanisms of control. Journal of Clinical Investigation, 47, 166-174.
3. Redgrave, T. G. (1970) Formation of cholesteryl ester-rich particulate lipid during metabolism of chylomicrons Journal of Clinical Investigation, 49, 465-471.
4. Cooper, A. D. (1977) The metabolism of chylomicron remnants by isolated perfused rat liver. Biochimica et Biophysica Acta, 488, 464-474.
5. Sherrill, D. C. & Dietschy, J. M. (1978) Characterization of the sinusoidal transport process responsible for uptake of chylomicrons by the liver. Journal of Biological Chemistry, 253, 1859-1867.
6. Cooper, A. D. & Yu, P. Y. S. (1978) Rates of removal and degradation of chylomicron remnants by isolated perfused rat liver. Journal of Lipid Research, 19, 635-643.
7. Windler, E., Chao, Y. & Havel, R. J. (1980) Regulation of the hepatic uptake of triglyceride-rich lipoproteins in the rat. Opposing effects of homologous apolipoprotein E and individual C apoproteins. J Biol Chem. 255, 8303-8307.
8. Wade, D. P., Anne K. Soutar, A. K. & Geoffrey F. Gibbons, G. F. (1984) Independent regulation of 3-hydroxy-3-methylglutaryl-coenzyme A reductasa and chylomicron remnant receptor activities in rat liver. Biochemical Journal, 218, 203-211.
9. Rodwell, V. W., Nordstrom, J. L. & Mitschelen, J. J. (1976) Regulation of HMG-CoA reductase. Advances in Lipid Research, 14, 1-74.
10. Ide, T., Tanaka, T. & Sugano, M. (1979) Dietary fat-dependent changes in hepatic cholesterogenesis and the activity of 3-hydroxy-3-methylglutaryl-CoA reductase in fasted-refed rats. Journal of Nutrition, 109, 807-818.
11. Zheng X, Avella M, Botham KM. Comparison of the effects of dietary n-3 and n-6 polyunsaturated fatty acids on very-low-density lipoprotein secretion when delivered to hepatocytes in chylomicron remnants. Biochemical Journal, 357, 481–487, 2001.
12. Tomkins, G. M., Chaikoff, I. L. & Bennett L. L. (1952) Cholesterol synthesis by liver. II. Effect of hypophysectomy. Journal of Biological Chemistry, 199, 543-545.
13. Xu, J., Cho, H., O’Malley, S., Park, J. H. Y. & Clarke, S. D. (2002) Dietary polyunsaturated fats regulate rat liver sterol regulatory element binding proteins-1 and -2 in three distinct stages and by different mechanisms. Journal of Nutrition, 132, 3333–3339.
14. Natali, F., Siculella, L., Salvati, S. & Gnoni, G. V. (2007) Oleic acid is a potent inhibitor of fatty acid and cholesterol synthesis in C6 glioma cells. Journal of Lipid Research, 48, 1966–1975.
15. Kabir, M., Skurnik, G., Naour, N., Pechtner, V., Meugnier, E., Rome, S., Quignard-Boulangé, A., Vidal, H., Slama, G., Clément, K., Guerre-Millo, M. & Rizkalla, S. W. (2007) Treatment for 2 mo with n_3 polyunsaturated fatty acids reduces adiposity and some atherogenic factors but does not improve insulin sensitivity in women with type 2 diabetes: a randomized controlled study. American Journal of Clinical Nutrition, 86, 1670-1679.
16. Connor, S. L. & Connor, W. E. (1997) Are fish oils beneficial in the prevention and treatment of coronary artery disease? American Journal of Clinical Nutrition, 66(suppl), 1020S-1031S.
17. Natali, F., Siculella, L., Salvati, S. & Gnoni, G. V. (2007) Oleic acid is a potent inhibitor of fatty acid and cholesterol synthesis in C6 glioma cells. J. Lipid Res. 48, 1966–1975.
18. Zheng, X., Avella, M. & Botham, K. M. (2001) Comparison of the effects of dietary n-3 and n-6 polyunsaturated fatty acids on very-low-density lipoprotein secretion when delivered to hepatocytes in chylomicron remnants. Biochemical Journal, 357, 481-487.
19. Harris, W. S., Connor, W. E., Alam, N. & Illingwoath, D. R. (1988) Reduction of postprandial triglyceridemia in humans by dietary n-3 fatty acids. Journal of Lipid Research, 29, 1451-1460.
20. Botham, K. M., Maldonado, E. N., Chico, Y., Zheng, X., Avella, M. & Ochoa, B. (2001) The influence of chylomicron remnants on cholesteryl ester metabolism in cultured rat hepatocytes: comparison of the effects of particles enriched in n-3 or n-6 polyunsaturated fatty acids. Biochimica et Biophysica Acta, 1534, 96-109.
21. Botham, K. M., Zheng, X., Napolitano, M., Avella, M., Cavallari, C., Rivabene, R. & Bravo, E. (2003) The effects of dietary n-3 polyunsaturated fatty acids delivered in chylomicron remnants on the transcription of genes regulating synthesis and secretion of very-low-density lipoprotein by the liver: modulation by cellular oxidative state. Experimental Biology and Medicine, 228, 143–151.
22. Rudel, L. L., Johnson, F. L., Sawyer, J. K., Wilson, M. S. & Parks, J. S. (1995) Dietary polyunsaturated fat modifies low-density lipoproteins and reduces atherosclerosis of nonhuman primates with high and low diet responsiveness. American Journal of Clinical Nutrition 62, 463S-470S.
23. Worgall, T. S., Johnson, R. A., Seo, T, Gierens, H. & Deckelbaum, R. J. (2002) Unsaturated fatty acid-mediated decreases in sterol regulatory element-mediated gene transcription are linked to cellular sphingolipid metabolism. Journal of Biological Chemistry, 277, 3878–3885, 2002.
24. Olson, R. E. (2002) The key to an enigma: how do dietary polyunsaturated fatty acids lower serum cholesterol? Journal of Nutrition, 132, 134–135.
25. Hegsted, D. M., McGandy, R. B., Myers, M. L. & Stare, F. J. (1965) Quantitative effects of dietary fat on serum cholesterol in man. American Journal of Clinical Nutrition, 17, 281-295.
===============================================================================
Capítulo anterior: 3 – Transporte de colesterol
Capítulo siguiente: 5 – Fuentes del colesterol endógeno
Enlaces relacionados de esta página Web:
Metabolismo
Hidratos de carbono
Ácidos grasos
Lipogénesis
Síndrome metabólico
Alimentación y dieta
Nuestros complementos nutricionales NutrHevia
Problemas de salud que podemos atender